1. Hur är en atom uppbyggd, vilka är
beståndsdelarna samt vilka egenskaper har dem
2. Grundämne (atom), jon, molekyl
3. Hur elektroner är ordnade i skal
4. Masstal, atomnummer, hur betecknas dessa tillsammans
med en kemisk beteckning?
5. Fast, flytande, gasform
6. Vilka vätskor leder ström och varför?
7. Kunna kemiska beteckningen för några
grundämnen och joner samt deras laddning
8. Laborationer
9. Frågor
Hur är en atom uppbyggd, vilka är beståndsdelarna samt vilka egenskaper har dem?
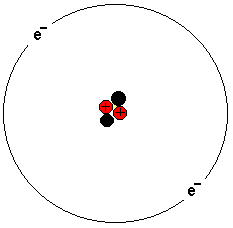
Bilden föreställer en heliumatom. Denna har två
protoner, två neutroner och två elektroner.
Atomen består av en atomkärna och elektroner som
kretsar kring atomkärnan.
Atomkärnan innehåller protoner och neutroner.
Protonerna är plusladdade och neutronerna är neutrala.
Atomens vikt utgörs i princip av atomkärnan.
Neutronernas uppgift är att hålla ihop protonerna.
Elektronerna är minusladdade. I en atom är antalet
elektroner exakt lika stort som antalet protoner i
kärnan.
Om atomkärnan skulle vara lika stor som en puttekula
och belägen i mitten på Ullevistadium, skulle
elektronerna cirkulera utanför läktarna och vara lika
stora som knappnålshuvuden. Det mesta hos atomen är
alltså tomrum eller vakuum.
En atom är så liten att den bara kan ses med
elektronmikroskop. Med ett elektronmikroskop kan man
förstora 500.000 ggr.
Grundämne (atom), jon, molekyl
Alla grundämnen presenteras i det periodiska systemet.
Dessa ämnen är bara uppbyggda av en sorts atomer.
Raderna 1-7 kallas perioder. Ämnena i varje period har
lika många elektronskal. I första perioden finns väte
och helium. Väte har en elektron och helium har två
elektroner. Dessa elektroner kretsar kring atomkärnan
i samma elektronskal. Period 2 har 2 elektronskal,
period 3 har 3 elektronskal etc...
Varje vertikal kolumn 1-18 nedåt kallas grupp. Det
finns 18 grupper. Alla ämnen i samma grupp har
liknande egenskaper.
Grupp 1 innehåller alkalimetallerna och alla dessa
ämnen reagerar våldsamt med vatten varvid de lämnar
ifrån sig en elektron och därmed bildar joner med
laddningen plus ett.
Grupp 2 kallas alkaliska jordartsmetaller. De vill
alla bilda joner med jonladdning 2+. Detta eftersom de
gärna donerar två elektroner.
Grupp 17 kallas halogener. Dessa bildar gärna salter
med alkalimetallerna (grupp 1). En halogen tar då emot
en elektron från en alkalimetall och blir på så sätt
minusladdad. Exempel: en natriumatom donerar en
elektron till en kloratom. Detta gör att natriumatomen
blir jon med laddning plus ett. Kloratomen som tar
emot en elektron blir jon med laddning minus ett.
Scenariot kan demonstreras då en bit natriummetall
läggs i en behållare med klorgas. Klorgasen är
livsfarlig att andas in. Likaså är natriummetallen
livsfarlig att äta. Då ämnen reagerar bildas som nyss
beskrivits natrium och kloridjoner. Tillsamman bildar
de saltet natriumklorid (NaCl) som med ett annat namn
kallas koksalt. Koksalt är helt ofarligt i begränsad
mängd. Koksalt går alltså att äta.
I grupp 18 längst till höger finns ädelgaserna. Dessa
vill inte reagera med andra ämnen.
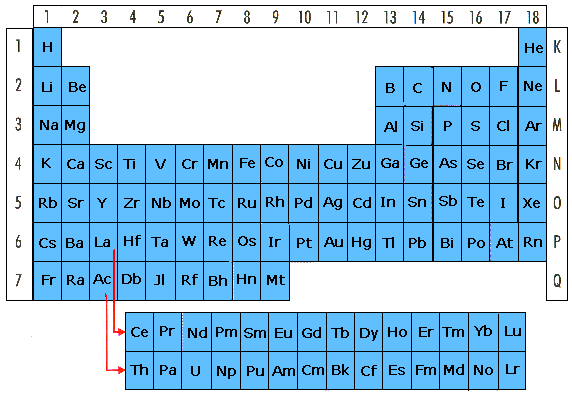
Hur
elektroner är ordnade i skal
Atomen ovan föreställer Argon - en ädelgas
belägen i periodiska systemet längst till höger.
Elektronerna kretsar i banor runt atomkärnan.
Skalen kallas inifrån och ut för K, L, M och N skalet.
Skalens namn är utsatta på bilden.
K skalet kan maximalt innehålla 2 elektroner
L skalet kan maximalt innehålla 8 elektroner
M skalet kan till att börja med maximalt innehålla 8
elektroner.
Elektroner fylls på i de olika skalen inifrån och ut.
Om atomen innehåller 6 elektroner, kommer två av dessa
att placeras i det innersta k-skalet och fyra kommer
att placeras i L-skalet.
En jon är ett grundämne som har fler eller färre
elektroner än protoner i kärnan. Detta gör att jonen
är laddad. Det finns alltså negativa joner och
positiva joner. Positiva och negativa joner tenderar
att dras mot varandra och bilda salter.
Molekyler är atomer i gäng. Exempel på molekyler är
koldioxid (CO2), kvävgas (N2) eller etanol (C2H5OH).
På det hela taget är en molekyl ej laddad. Atomerna i
molekylerna binder till varandra eftersom de delar
elektroner. En vätemolekyl (H2) har två gemensamma
elektroner. En elektron kommer från varje väteatom.
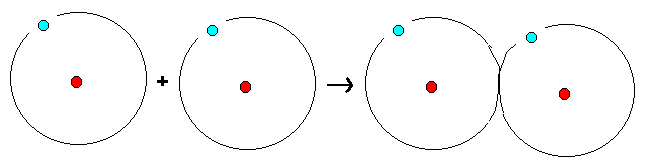
Alla atomer har en viss strävan att bilda
ädelgasstruktur i sitt yttersta skal. Väteatomen vill
likna heliumatomen och då fylla sitt yttersta skal med
två elektroner. Denna ädelgasstruktur skapas då varje
väteatom lånar en elektron från en annan väteatom (se
nedan).
Se det periodiska systemet ovan. Längst till höger
finns ädelgaserna. Helium längst upp har två
elektroner i sitt yttersta skal. Alla ädelgaser under
har åtta elektroner i sitt yttersta skal. Väteatomer
vill ha två elektroner i sitt yttersta skal medan de
flesta andra atomerna i det periodiska systemet
strävar efter att ha åtta elektroner i sitt yttersta
skal.
Masstal och atomnummer. Hur betecknas dessa
tillsammans med en kemisk beteckning?
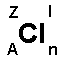
Till vänster visas den kemiska beteckningen för klor
(Cl). Runt omkring klor visas ett antal bokstäver.
A = Atomnummer. Atomnumret visar antalet protoner i
kärnan. 1H (väte) och 2He (helium). Atomnumren ökar
längs varje period enl. 1H, 2He,
3Li, 4Be, 5B, 6C,
7N,
8O, 9F, 10Ne, 11Na, etc..
Z = Masstal. Masstalet visar antalet protoner plus
antalet neutroner i kärnan. Ex 1H och 4He. Titta i ett
mer detaljerat periodisk system och leta efter
masstalen.
l = Laddning. Om grundämnet befinner sig i jonform
brukar man ange laddning här. Ex. Na+ och SO42-
n = Antal atomer som sitter ihop molekylen. Ex H2
(vätemolekyl), CO2 (koldioxid).
Fast, flytande och
gasform
Ett ämne kan befinna sig i fast, flytande eller
gasform. I vilken form ämnet befinner sig beror på
temperatur och vilket ämne det gäller. Vid den
absoluta nollpunkten vid -273 oC rör sig atomerna i
ämnet ingenting alls. Vi denna temperaturen befinner
sig alla ämnen i fast form.
Fast form:
När temperaturen stiger börjar atomerna vibrera fast
de befinner sig ändå på samma ställe och inordnat i
ämnets struktur. Om vi tar vatten som exempel har
atomerna i isen inga rörelser vid -273 oC. Vi låter
temperaturen stiga och atomerna i vattenmolekylerna
börjar vibrera mer och mer. Ändå befinner sig vattnet
i fast form.
Flytande form:
Temperaturen är nu 0 oC, och isen börjar smälta.
Vattnet övergår till flytande form. I flytande form
har molekylerna i vattnet släppt sin ordnade struktur
och molekylerna rör sig nu runt omkring i vattnet.
Alla vattenmolekyler får hela tiden nya grannar.
Vattnets temperatur stiger till 100 oC.
Vattenmolekylerna byter nu grannar ännu mer ofta
eftersom de har mer energi.
Gasform:
Temperaturen är nu 100 oC. Mer energi tillförs
vattnet. Den extra energin tas upp av vissa
vattenmolekyler som använder denna till att frigöra
sig från lösningen. Vattenmolekylen försvinner iväg
från det flytande vattnet. Vattnets temperatur kommer
inte att vara mer än 100 oC i vattnet. All energi som
sätts till plockas upp av vattenmolekyler som sticker
ifrån lösningen. Vattnet övergår till gasform. När
allt vattnet övergått till gasform finns inget vatten
kvar i behållaren. Allt vatten har kokat bort.
Vilka vätskor
leder ström och varför?
En lösning leder ström om den innehåller laddade
joner.
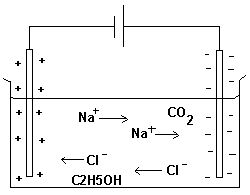
Karet till vänster innehåller vatten med tillsatser av
koksalt (NaCl), koldioxid (CO2) och etanol (C2H5OH).
Laddningar av olika slag attraheras till varandra.
Detta gör att batteriets minuspol attraherar
natriumjonerna och pluspolen attraherar kloridjonerna.
Etanolmolekylerna och koldioxidmolekylerna som ej är
laddade kommer inte att söka sig till en laddad pol.
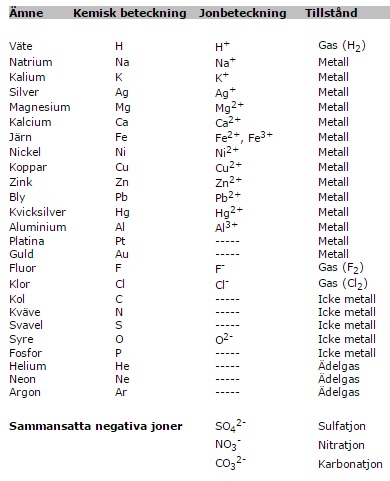
Kunna kemiska beteckningen för några enkla grundämnen
och joner samt deras laddning.
Laborationer
1.
Värm vatten i degel med bunsenbrännare (gasolbrännare)
- laborationsrapport
2.
Värm kaliumnitrat (KNO3) i degel med gasolbrännare -
laborationsrapport.
3.
Värm socker i degel med gasolbrännare -
laborationsrapport
Diskutera resultaten med lärare
Frågor
1.
Hur är en atom uppbyggd?
2.
Vilka beståndsdelar finns i en atom - vilka egenskaper
har beståndsdelarna?
3.
Vad är det som väger mest i en atom? - protonerna
eller elektronerna?
4.
Vad är det för skillnad mellan jon och atom?
5.
Vad är en molekyl - förklara fullständigt?
6.
Vad är det för skillnad mellan en atom och en molekyl?
7.
Var är halogener?
8.
Vad är ädelgaser för någonting - vad har de för
egenskaper?
9.
Vilka egenskaper har alkalimetallerna?
10.
Varför väljer vissa atomer att bilda molekyler?
11.
Vad är atomnummer?
12.
Vad är masstal?
13.
Vad innebär fast, flytande och gasform?
14.
Tala om vad som händer med vattenmolekylerna då
temperaturen är -273 grader Celsius och den sakta
stiger till 100 grader Celsius.
15.
Vilka vätskor leder ström och varför?
16.
Vilken jonladdning har oftast metallatomerna då de
bildar joner.
17.
Varför får halogenerna alltid laddningen minus ett som
joner?
18.
Varför får alkalimetallerna alltid laddningen plus ett
som joner.
19.
Förklara hur två livsfarliga ämnen kan reagera med
varandra för att bilda ett ofarligt ämne.
20.
Leder etanol ström - varför?
21.
Leder koksalt ström - varför?
De naturvetenskapliga grundkurserna för högstadiet är skrivna av Lars Helge Swahn. Kurserna är utvecklade under 9 års tid och har använts för höstadiets åk 8 och 9. De är ämnade att ge snabbt eleven en övergripande bild om respektive arbetsområde. För LPO 94 täcker kurserna nivån G och ger även viss information för betyget VG.
Copywrite NGU, Northern Pontifical Academy 2025 (A.I.C.)