1. Kemiska beteckningar på de vanligaste atomslagen
- känna till jonladdning på de vanligaste olika kemiska jonerna.
2. Elektrokemiska spänningsserien
3. Oxidation och reduktion
4. Redoxreaktioner
5. Elektrolys
6. Elektrodreaktioner och PANK regeln
7. Katjon och Anjon
8. Elektrolys av olika saltlösningar - vad händelser?
- Känna till rent teoretiskt vad som händer då olika lösningar
elektrolyseras.
- Vad kommer hända med katod och anod.
9. Hur förnicklar man eller förzinkar föremål?
10. Galvaniskt element (Batteri)
11. Konsekvenser av elektrokemiska spänningsserien
12. Frågor
Kemiska beteckningar på de vanligaste atomslagen - känna till jonladdning på de vanligaste olika kemiska jonerna
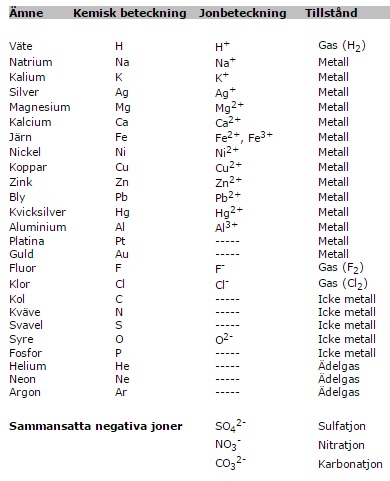
Elektrokemiska spänningsserien:
![]()
Alla metaller i det periodiska systemet finns
egentligen med i de den elektrokemiska
spänningsserien. I den elektrokemiska spänningsserien
ovan finns de metaller som vi skall arbeta med. Längst
till vänster finns oädla metaller och ju längre till
höger man kommer desto mer ädla blir metallerna.
Metallerna till vänster om väte (H) kallas för oädla
metaller medan de till höger kallas ädla metaller. Om
två olika metaller slåss om elektroner kommer den
ädlaste att vinna elektroner. Alla syror innehåller
vätejoner (H+) vilka löser upp oädla metaller till
joner. Ädla metaller påverkas inte av syraangrepp.
Oxidation och reduktion
Oxidation innebär att en atom eller jon avger en eller
flera elektroner och på så sätt ökar i elektrisk
laddning. ex. oxidation av järn till järnjoner.
![]()
Reduktion innebär att en atom eller jon tar upp en
eller flera elektroner och på så sätt minskar i
elektrisk laddning. ex. reduktion av kopparjoner till
koppar.
![]()
Redoxreaktioner
När en oxidation sker så sker alltid en samtidig
reduktion. Man talar därför om redoxreaktioner. Tittar
vi på exemplen ovan så kan en oxidation bara ske då en
reduktion sker. Om järn är nedsänkt i kopparjoner
(kopparsulfat) sker alltså båda reaktionerna
samtidigt. Reaktionerna kan skrivas ihop på följande
sätt.
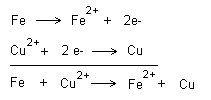
Vill man markera elektronövergång så görs detta på
följande sätt.
![]()
Koppar är alltså ädlare än järn och koppar vinner
därför kampen om elektronerna
Elektrolys
Med hjälp av elektrisk ström kan man driva reaktioner.
Nedan visas elektrolys av saltsyra (HCl). Vid
minuspolen (katod) skapas vätgas och vid pluspolen
(anod) skapas klorgas. Vätgasen antänds av värmen från
en tändsticka (ca: 500 oC) och klorgasen som bildas är
giftig. Elektroderna består av grafit.
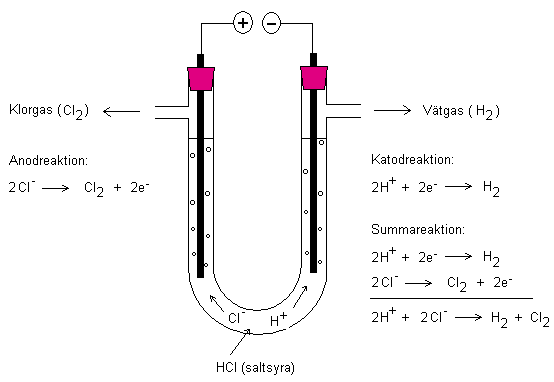
Elektrodreaktioner och PANK-regeln
Ovan visas elektrodreaktioner för elektrolys av
saltsyra. Pluspolen är en elektrod och minuspolen är
också en elektrod. Vid dessa elektroder sker kemiska
reaktioner. Om elektroden är en pluspol kallar man den
anod. Minuspolen kallas katod.
För att lättare komma ihåg vilken elektrod som är
vilken så kan man använda sig av PANK-regeln. PANK
står för positiv anod negativ katod. Katoden är
negativ eftersom batteriet ovan har elektroner i
överskott som vill levereras.
Anoden är positiv eftersom det finns ett underskott på
elektroner här. Negativa joner vill till anoden. I
ovanstående fall vill kloridjoner (Cl-) till anoden
och avge en elektron var. Då bildas klorgas. Varje
kloratom parar ihop sig med en annan kloratom. Detta
gör att båda kloratomerna upplever att de har 8
elektroner var i sitt respektive yttersta skal. En
kovalent bindning har skapats och molekylen som har
skapats kallas klorgasmolekyl (Cl2).
På samma sätt parar vid katoden två väteatomer ihop
sig till en vätgasmolekyl (H2). Detta först efter att
båda vätejoner har tagit upp var sin elektron.
Katjon och Anjon
De joner som vill till katoden (negativa polen) kallas
för katjoner ex. Na+, Mg+2, Ca+2, Cu+2, Zn+2, Al+3,
dvs alla positiva joner.
De joner som vill till anoden (positiva polen) kallas
för anjoner ex. Cl- , F-, SO4-2, CO3-2, dvs alla
negativa joner.
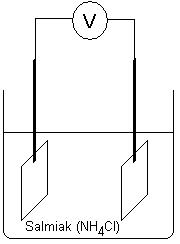
Elektrolys av olika saltlösningar - vad händelser? Känna
till rent teoretiskt vad som händer då olika lösningar
elektrolyseras.
Vad kommer hända med katod och anod
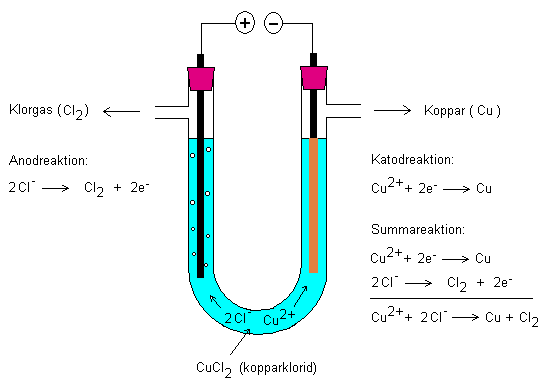
Nedan elektrolys av kopparklorid.
Hur
förnicklar man eller förzinkar föremål?
Detta kan göras med hjälp av elektrolys. Använd
zinkjoner (Zn2+) eller nickeljoner (Ni2+) i lösning.
Låt metallföremålet som skall förzinkas eller
förnicklas vara som minuspol (katod). Använd likström
och sätt igång processen. Elektroner kommer då att
befinna sig här och reducera zink- eller nickeljonerna
till rent zink eller nickel.
Galvaniskt element (Batteri)
Alla metallerna i den elektrokemiska spänningsserien
har olika stor förmåga att oxidera andra metaller, dvs
få den andra metallen att avge elektroner som dom
själva skall ha. En metall som oxiderar en annan
metall kallas oxidationsmedel och metallen som blev av
med elektronen eller elektronerna har då oxiderats.
På motsvarande sätt kan en metall vara ett
reduktionsmedel om den istället avger elektroner till
en annan metall. Den andra metallen sägs då ha
reducerats, dvs fått en lägre laddning.
Ex.
![]()
Kopparjonerna: oxidationsmedel (oxiderar järnatomer).
Kopparjonerna reduceras själva till koppar.
Järn: reduktionsmedel (reducerar kopparjoner).
Järnatomerna oxideras själva till järnjoner.
Man kan låta de två metallerna "göra upp" i
(boxnings-)ringen och slåss om elektronerna. Den
ädlaste metallen kommer att vinna elektronerna och den
svagare kommer att förlora. De olika metallernas
förmåga att ta upp elektroner mäts i jämförelse med
vätgas, som utgör gränsen mellan ädla och oädla
metaller. Förmågan mäts i volt (spänning). De båda
metallernas förmåga jämförs och det kommer att flyta
en elektrisk ström i ledningen mellan elektroderna.
De båda metallblecken i vätskan nedan utgörs alltså av
två olika metaller. Den elektrod som avger elektroner
till den andra metallen genom ledningen kallas
minuspol (katod). Den elektrod som får elektroner till
sig kallas för pluspol (anod). Voltmetern kommer att
visa en spänning. Vi har skapat ett batteri. Om den
ena elektroden hade varit koppar (anod) och den andra
hade varit järn (katod) så hade voltmetern visat ca:
0,3-0,4V. Hade elektroderna varit silver (anod) och
zink (katod) så hade voltmeterns visat ca: 1,50-1,60
V. Jonkoncentrationen mellan elektroderna påverkar
också en aning till vilken spänning det blir mellan
elektroderna. Från tabeller kan man räkna ut
spänningen mellan elektroder av olika metallslag. Här
gäller att jonkoncentrationen i elektrolyten skall
vara 1 mol/dm3 (1 molar) och att atmosfärstrycket
skall vara 1 bar.
Konsekvenser av elektrokemiska spänningsserien
Om man skall spika fast ett koppartak så skall man
använda kopparspik. Om man använder järnspik så kommer
järnet att donera elektroner till kopparen enligt
ovan. Det finns ju alltid lite fukt med salter mellan
kopparn och spiken på ett tak. En galvanisk ström
kommer att bildas, och järnspikarna kommer att
oxideras till järnjoner. Kanske kommer den mer hyfsade
och allmänt accepterade svordomen "järnspikar" från
denna förmodligen surt förvärvade erfarenhet.
Frågor:
1.
Skriv kemisk beteckning för Sulfatjon, Nitratjon och
Karbonatjon?
2.
Vad visar den elektrokemiska spänningsserien?
3.
Varför kan man ordna alla metaller i den
elektrokemiska spänningsserien - vilken egenskap
jämförs?
4.
Vilka metaller är oädla?
5.
Vilka metaller är ädla?
6.
Vad utgör gränsen mellan ädla och oädla metaller?
7.
Vad innebär oxidation?
8.
Vad innebär reduktion?
9.
Vad är en redoxreaktion - ge också ett exempel på en
redoxreaktion. Markera även elektronövergång.
10.
Beskriv elektrolys av saltsyra? Rita uppställning och
skriv upp elektrodreaktioner samt summareaktion.
11.
Hur skulle du kunna testa vilken gas som bildas vid de
båda polerna till ovanstående fråga?
12.
Beskriv elektrolys av kopparklorid? Rita uppställning
och skriv upp elektrodreaktioner samt summareaktion.
13.
Hur skulle du kunna se vilka ämnen som bildas vid de
båda polerna till ovanstående fråga?
14.
Vad är ett galvaniskt element?
15.
Vad tävlar de båda metallerna om i ett galvaniskt
batteri?
16.
Hur mäter man det?
17.
Vilken elektrod (anoden eller katoden) kommer alltid
att vinna elektronerna?
18.
Vilken elektrod (anoden eller katoden) kommer alltid
att förlora elektronerna?
19.
Varför skall man spika fast ett koppartak med
kopparspik?
20.
Varför skall man inte spika fast ett plåttak med
kopparspik?
21.
Hur förzinkar man ett metallföremål?
De naturvetenskapliga grundkurserna för högstadiet är skrivna av Lars Helge Swahn. Kurserna är utvecklade under 9 års tid och har använts för höstadiets åk 8 och 9. De är ämnade att ge snabbt eleven en övergripande bild om respektive arbetsområde. För LPO 94 täcker kurserna nivån G och ger även viss information för betyget VG.
Copywrite NGU, Northern Pontifical Academy 2025 (A.I.C.)