Energiändringar vid reaktioner
Då vissa ämnen regagerar avges
energi. Man säger i så fall att reaktionerna är
exoterma. Här kommer exempel på exoterma reaktioner:
Druvsocker förbränns i kroppens cellreaktion under
inverkan av syrgas:
(1)
C6H12O6 + O2
 CO2 + H2O +
energi
CO2 + H2O +
energi
Vätgas reagerar tillsammans med syrgas:
(2)
2H2 + O2
 2H2O +
energi
2H2O +
energi
Vätgas och klorgas reagerar:
(3)
H2 + Cl2
 2HCl +
energi
2HCl +
energi
Då vissa ämnen regagerar upptas energi. Man säger
i så fall att reaktionerna är endoterma. Här
kommer exempel på enodterma reaktioner:
Druvsocker bildas under inverkan av koldioxid genom
vätxters fotosyntes. Solenergi behövs:
(4)
energi + CO2 + H2O
 C6H12O6 + O2
C6H12O6 + O2
Vatten sönderdelas under inverkan av likriktad
elektricitet:
(5)
energi + 2H2O
 2H2 + O2
2H2 + O2
Elektrolys av saltsyra:
(6)
energi + 2HCl
 H2
+ Cl2
H2
+ Cl2
Vad händer när kemiska bindningar bryts?
Då kemiska bindningar bryts åtgår alltid energi.
Så här mycket energi åtgår för att kunna bryta följande
bindningar:
C - H 423 kJ / mol
O - H 464 kJ / mol
N - N 945 kJ / mol
O - O 138 kJ / mol
O = O 497 kJ / mol
C = O 803 kJ / mol
H - H 436 kJ / mol
I - I 151 kJ
/ mol
H - Cl 431 kJ / mol
Cl - Cl 242 kJ / mol
Vad händer när kemiska bindningar bildas?
Då kemiska kemiska reaktioner bildas frigörs alltid
energi. Det frigörs exakt lika mycket energi som
behövs för att bryta bindningen. Så för att skapa
exempelvis 1 mol bindningar hos vätgas (H2),
frigörs 436 kJ (se tabell ovan).
Uppgift:
Räkna ut hur mycket energi som frigörs respektive åtgår
i ovanstående (2), (3), (5), (6) exoterma och endoterma
reaktioner:
Svar:
(2) 487 kJ frigörs för bildning av 2 mol vatten.
(3) 184 kJ frigörs för bildning av 2 mol väteklorid
eller saltsyra
(5) 487 kJ åtgår
(6) 184 kJ åtgår
Reaktioners förlopp - energinivådiagram
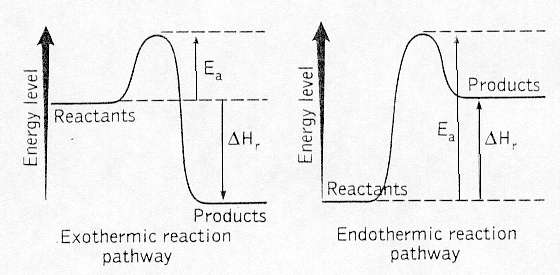
Bilden är tagen från okänd källa
I fall 1 och 2 i bild ovan åtgår energi för att få reaktion att
ske. Denna energi Ea kallas aktiveringsenergi. Kullen
(Ea) representerar det hinder som måste övervinnas för
att reaktionen skall kunna ske. Då kullen är passerad
frigörs energi. Då energin som frigörs är större än
aktiveringsenergin är reaktionen exoterm vilket gör att
energi summa summarum i reaktionen frigörs. Då energin
som frigörs är mindre än aktiveringsenergin är
reaktionen endoterm vilket gör att energi summa summarum
i reaktionen åtgår.
Entalpi
Den energimängd som finns i 1 mol av ett ämne kallas
ämnets värmeinnehåll eller entalpi.
För exoterma reaktioner kan vi se att produkten eller
produkternas energiinnehåll är mindre än reaktantens
eller reaktanternas. Energi har alltså avgivits till
omgivningen. Entalpiändringen (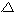 H)
är alltså differensen mellan produkters och reaktanters
energiinnehåll. Exoterma reaktioner får då en negativ
entalpiändring dvs.
H)
är alltså differensen mellan produkters och reaktanters
energiinnehåll. Exoterma reaktioner får då en negativ
entalpiändring dvs. 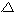 H < 0. Se fall
1 ovan.
H < 0. Se fall
1 ovan.
Hos endoterma reaktioner är produkterna mer energirika
än reaktanterna. Detta gör att differensen mellan
produkters och reaktanters energiinnehåll är positiv.
Entapändringen är alltså 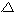 H > 0. Se
fall 2 ovan.
H > 0. Se
fall 2 ovan.
Exoterm reaktion
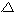 Hr = Hprodukter - Hreaktanter
Hr = Hprodukter - Hreaktanter
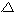 Hr för en exoterm reaktion är
alltid negativ. Se exempel för reaktion (2) och (3)
ovan.
Hr för en exoterm reaktion är
alltid negativ. Se exempel för reaktion (2) och (3)
ovan.
(2) 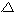 Hr = - 487 kJ
Hr = - 487 kJ
(3) 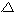 Hr = - 184 kJ
Hr = - 184 kJ
Endoterm reaktion
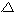 Hr = Hprodukter - Hreaktanter
Hr = Hprodukter - Hreaktanter
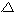 Hr för en endoterm reaktion är
alltid positiv. Se exempel för reaktion (3) och (4)
ovan.
Hr för en endoterm reaktion är
alltid positiv. Se exempel för reaktion (3) och (4)
ovan.
(3) 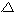 Hr = + 487 kJ
Hr = + 487 kJ
(4) 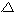 Hr = + 184 kJ
Hr = + 184 kJ
Uppgift:
Teckna energinivådiagram för reaktioner 2,3,5,6 ovan.
Formler och beteckningar
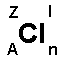
A = Z + N, där
A = masstalet (antalet nukleoner)
Z = protontalet (antal protoner)
N = neutrontalet (antalet neutroner)
l = laddning
n = antal atomer i molekylen (om 2 eller fler)
Molberäkning
1 u = 1,661×10-27 kg (1/12 av atommassan 12C)
1 mol = 6,022×1023 (antal formelenheter - Avogadros
konstant)
_____________________________________
n = m/M
n = mängden av ämnet (mol)
m = massa (g)
M = molmassan för ämnet (g/mol)
_____________________________________
c = n/V
c = lösningens koncentration (mol/dm3 eller M)
n = antalet mol av ett ämne i lösning
V = lösningens volym (dm3)
_____________________________________
pV = nRT Gasernas allmänna tillståndsekvation
p = gasens tryck (Pa)
V = gasens volym (m3)
n = gasens mängd (mol)
R = 8,31 J×mol-1×K-1 (gaskonstanten)
T = temperaturen (K)
1 mbar = 100 Pa = 0,1 kPa
1 atm = 1,013×105 Pa
_____________________________________
pA + qB
 rC + sD Massverkans lag - för denna
jämviktsekvation lyder jämviktsvillkoret:
rC + sD Massverkans lag - för denna
jämviktsekvation lyder jämviktsvillkoret:
([C]r×[D]s) / ([A]p×[B]q ) = K
[A], [B], [C] och [D], anger koncentrationerna av ett
ämne när jämvikt inträtt. K är en konstant
(jämviktskonstant) - specifik för denna reaktionen.
_____________________________________
Syror och baser
pH = -lg[H30+], [H30+] = 10-pH
pOH = -lg[OH-], [OH-] = 10-pOH
[H30+] × [OH-] = Kw Kw = 1 × 10-14
pH + pOH = pKW pKW = 14
_____________________________________
De naturvetenskapliga grundkurserna för högstadiet är skrivna av Lars Helge Swahn. Kurserna är utvecklade under 9 års tid och har använts för höstadiets åk 8 och 9. De är ämnade att ge snabbt eleven en övergripande bild om respektive arbetsområde. För LPO 94 täcker kurserna nivån G och ger även viss information för betyget VG.
Copywrite NGU, Northern Pontifical Academy 2025 (A.I.C.)